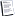 Maddenin Yapisi - Elementler Tablosu
Maddenin Yapisi - Elementler Tablosu
Şimdi elementler tablosunu inşa etmek üzere; nötür bir hidrojen atomu alıp, çekirdeğine bir proton daha koyalım. Çekirdeğin yükü 1 arttığından, yörüngedeki tek elektron, daha büyük bir kuvvetle çekilmektedir ve yarıçap, hidrojene göre küçülür. Öte yandan, 1s yörüngesinin dağılımı küresel simetrik olduğundan, bu elektron çekirdeğin yükünün, hemen hemen yarısını kamufle etmiştir. Dolayısıyla He+ iyonu elde edilmiş olur. 1s yörüngesine bir elektron daha konduğunda, nötür helyum atomu elde edilecektir. Bu ikinci elektron çekirdeğin yükünü, yaklaşık olarak +1 görür ve sanki hidrojen atomunun 1s yörüngesine yerleşmiş gibidir. Ancak, elektronların enerji düzeyleri, hidrojeninkine göre biraz daha aşağı kaymış, atomun yarıçapı da biraz küçülmüştür. Öte yandan, Pauli'nin dışlama ilkesi elektronların aynı 'kuantum durumu'nu paylaşmasını yasakladığından; hiç değilse 'spin kuantum sayıları'nın farklı, yani spinlerin zıt yönlerde olması gerekir. Sonuç olarak; 2 elektronlu helyumun yörünge şeması 1s2 olur ve spinler zıt yönde, birbirini götürmektedir.
Şimdi nötür bir helyum atomu alıp, çekirdeğine bir proton eklersek, elektronlar çekirdeğe biraz daha yaklaşır. Dışarıyla karşı net yük, 1s2 elektronlarının kamuflajı nedeniyle, +1 olarak görünmektedir. Ortaya Li+ iyonu çıkmıştır ve nötür atomu verecek olan üçüncü elektron, 2s yörüngesine yerleşmek durumundadır. Gerçi bu üçüncü elektron, +1 yüklü bir hidrojen çekirdeği görmekte gibidir. Fakat yeni bir yörünge kabuğuna oturmak zorunda olduğundan, 1s2 elektronları çekirdeğe yaklaşmış olsalar dahi, atomun yarıçapı sonuç olarak büyür. Çünkü her yeni kabuk devreye girdiğinde; atomun yarıçapında yer alan büyüme, çekirdek yükünün artışından kaynaklanan küçülmeye oranla baskındır. Sonuç olarak Li'un yörünge şeması 1s22s1 olur. 1s2 elektronlarının spinleri zıt yönlerde olup birbirini götürdüğünden, 2s1 elektronunun spini eşleşmemiş kalır. Atom bir manyetik alana yerleştirildiğinde, bu spinin, alan yönüne paralel veya zıt olmasına göre, atomun enerji düzeyi az biraz değişir.
Bu şekilde devam ederek, diğer elementlerin yörünge şemaları birer birer elde edilebilir. Örneğin, lityumdan sonra gelen berilyum 1s22s2, boron ise 1s22s22p1 yörünge şemalarına sahiptir. Borondaki eşleşmemiş olan 2p1 elektronunun spini, bir manyetik alanın varlığında, yörünge açısal momentumundan (l) bağımsız bir tepki vermek yerine, önce onunla birleşmek ('coupling') eğilimindedir. 'Spin yörünge birleşmesi' denilen bu olgunun sonucunda ortaya çıkan toplam açısal momentum j; l-½ veya l+½ değerlerini alablilir. Bu toplam açısal momentumun manyetik alan yönündeki bileşeni (m) ise; kuantum sıçramaları gösterir ve -j ile +j arasındaki 2j+1 adet değerden (-j, -j+1,... j-1, j), herhangi birine sahip olabilir. Toplam açısal momentumun manyetik alana göre bu farklı yönelişleri, elektronun enerji düzeyini, az da olsa değiştirir. Dolayısıyla, aynı bir tek (n, l) çifti için; m değeri arttıkça yükselen, farklı enerji düzeyleri söz konusu hale gelir. Buna bir enerji düzeyinin ayrışması ('splitting') denir. "Manyetik alan nereden çıktı?" diyecek olursanız; elektronların yörünge hareketi akım anlamına geldiğinden, dış elektronlar açısından; iç elektronların yol açtığı böyle bir manyetik alan, şiddeti zayıf da olsa, elekron sayısı birden büyük ve tek olan hemen her atomda vardır.
Son olarak bir de, karbon atomuna bakalım. Nötür bir boron atomunun çekirdeğine bir proton daha ekleyip, Z=6'ya çıktık diyelim. Elimizde bir C+iyonu var ve nötür karbon atomunu elde etmek için, 1s22s22p1 yörünge şemasına bir elektron daha eklemek durumundayız. En dıştaki 2p grubunda 3 yörünge var ve bunlardan birinde halen bir elektron bulunuyor. Yeni gelen elektron, bu elektronla aynı yörüngeyi paylaşabilir. Ancak Pauli'nin dışlama ilkesine göre, spinlerin zıt yönlerde olması gerekir. Halbuki bu durumda iki elektron, iç elektronların oluşturduğu manyetik alan içerisinde, zıt yönlerde duran iki mıknatıs gibi olacaktır. Gerçi mıknatıslar; kendilerininkinden daha güçlü bir dış manyetik alanın yokluğunda, zıt yönlerde konumlanarak, toplam potansiyel enerjilerini azaltmak eğilimindedirler. Ancak böyle bir dış manyetik alan varsa eğer, toplam potansiyel enerjinin azaltılması açısından, mıknatısların birbirlerine göre yönelişleri öneminden kaybedip, ikinci plana düşer ve mıknatısların her ikisi de, dış manyetik alanın tersi yönde, yani birbirlerine paralel şekilde konumlanmayısısı tercih ederler. Dolayısıyla, yeni gelen elektron; 2p1 elektronuyla aynı yörüngeyi paylaşmak uğruna spinini zıt yönlendirmek yerine; bir diğer 2p yörüngesine yerleşerek, spinlerin paralel kalmasını sağlar. Böylelikle; negatif işaret taşıyan potansiyel enerjisini arttırıp, toplam enerjisini azaltmış olur. Aynı nedenle, 1s22s22p3 yörünge şemasına sahip bulunan nitrojen atomunun 2p grubundaki üç elektronu, farklı 2p yörüngelerinde oturur. Ancak sıra 1s22s22p4 şemasına sahip oksijene geldiğinde, 2p grubundaki dördüncü elektron; çok daha yüksek enerjili n=3 kabuğuna geçmektense, diğer üçünden biriyle aynı yörüngeyi paylaşmayısısa razı olur. Spini, diğerininkine zıt yönde olmak kaydıyla.
Ayrıntıymış gibi görünen bu değerlendirmeler bize, kimyada elementlerin yörünge dizilimlerinin inşasında kullanılan ve bulucusunun adıyla 'Hundt kuralı' olarak anılan güçlü bir anahtar veriyor: Herhangi bir l≥2 yörünge grubuna elektronların yerleştirilmesi sırasında; önce her yörüngeye, spinleri paralel birer elektron yerleştirilir ve grupta başka yörünge kalmayısısınca, ters spinli elektron eşleştirmelerine geçilir. Elementlerin elektron dizilimiyle ilgili, bir kural veya kuralsızlık daha var.
Enerji kuantum sayısının, n=1'den başlayarak artan değerlerine karşılık gelen yörünge kabuklarına, tarihsel kullanımdan gelen alışkanlıkla, sırasıyla K, L, M, N kabukları deniyor. Hidrojen atomunda, birbirini izleyen kabuklar arasındaki enerji aralığı; iki kabuktan herhangi birinin içinde yer alan farklı alt yörünge grupları arasındaki enerji farkından daha büyük oluyor. Fakat daha önce de sözünü ettiğimiz gibi, diğer elementlere ait yörüngelerin enerji düzeyleri; bir yandan çekirdek yükünün artması, diğer yandan bu yükün bir kısmının iç elektronlar tarafından kamufle ediliyor olması nedenleriyle, hidrojendekinin aynı olamıyor. Bu durum, elektronların spin ve açısal momentum aracılığıyla etkileşime girmeleri sonucu; özellikle daha kalabalık olan yörünge gruplarında, daha da karmaşıklaşıyor. O kadar ki; örneğin belli bir kabuktaki d ve f yörüngelerinin enerji düzeyleri, bir veya daha sonraki kabuğun içine kayacak kadar artabiliyor. Dolayısıyla yörüngelerin, kimyada 'Hundt kuralı' olarak anılan doldurulma sırası ve barındırdıkları elektron sayıları şöyle:
1. period:1s222. period:2s2 2p6 83.period: 3s2 3p684.period: 4s2 3d10 4p6185. period:5s2 4d10 5p6186. period: 6s2 4f145d10 6p6327.period:7s2 5f14 6d10 7p6 32
Aşağıdaki şekilde, bu dizilişe göre ve artan atom numarasıyla sıralanmış bulunan elementler tablosu görülüyor.
Bir elementin kimyasal özelliklerini hemen tümüyle, dizilişinin en dış kabuğundaki elektron sayısı belirliyor. Bu sayıya, o elementin kimyasal 'değer'ini belirleyen sayı anlamında, 'değer sayısı' ('valence') deniyor. Çünkü en dış kabuğu dolu olan atomlar, diğer atomlarla ilişkileri açısından daha büyük bir kararlılık sergiliyor ve diğerleri de, duruma göre; ya bu dış kabuktaki elektronlarından kurtulmak veya kabuğu tümüyle doldurmak suretiyle, benzeri bir kararlılığı kazanmak eğiliminde oluyor.
Hidrojen için bu sayı 1. Nötür bir hidrojen atomu bu haliyle, kimyasal tepkimeye girme fırsatı bulduğunda; ya bu elektronunu da verip, kurtulmak veya bir elektron daha alıp, 1s kabuğunu doldurmak gibi iki seçeneğe sahip görünüyor. Fakat, mevcut elektron tarafından yükü büyük oranda kamufle edilmiş bulunan çekirdek, ikinci bir elektronu yörüngede tutacak çekme kuvvetini uygulayamıyor. Dolayısıyla hidrojen, girdiği kimyasal tepkimelerde hep, elektron vererek, + yüklü iyon haline geçiyor. Elektrostatik açıdan + yüklü olmayısısı tercih ettiğinden, 'elektropozitif' olduğu söyleniyor. Hem de bunu güçlü bir şekilde yaptığından, 'güçlü bir elektropozitif element' olarak nitelendiriliyor. Veya elektron tutkusunun ('affinity') zayıflığından söz ediliyor. Helyum ise, tek ve en dış olan kabuğu zaten dolu olduğundan, elektron alış verişlerine, yani kimyasal tepkimelere pek yanaşmıyor. Dolayısıyla, soygaz olarak biliniyor. Çekirdeğinin yükü veya çekim kuvveti, hidrojeninkinden daha büyük olduğundan, yarıçapı daha küçük.
Atom numarası sıralamasında bir sonra gelen Li, en dış 2s kabuğunda tek bir elektrona sahip. Dolayısıyla, kimyasal tepkimelerinde aynı hidrojen gibi, 'elektropozitif' davranıyor. Zaten bu yüzden, kimyasal özelliklerinin benzerliğinden dolayı, tabloda hidrojenin altına konmuş. Hatta lityumun 2s elektronu, hidrojenin 1s elektronundan daha yüksek bir enerji düzeyinde. Dolayısıyla lityum bu elektronunu, hidrojenden daha bile kolay verebiliyor. Yani elektropozitifliği daha yüksek. Çekirdek yükünün daha büyük olmasına karşın, n=2 değerli yeni bir kabuğa geçilmiş olduğundan, yarıçapı hidrojeninkinden daha büyük. Saf hali, olağan koşullarda katı. Bir tepkimeye giremediği bu durumda dahi, 2s elektronuna karşı tutkusu çok zayıf ve bu 'değer elektronu' çoğu zaman, kristal yapı içerisinde serbestçe dolaşabiliyor. Bu yüzdendir ki saf lityum; yüksek ısıl ve elektrik iletkenliğiyle, güçlü metal özellikleri sergiliyor.
Ardından gelen berilyum, aynı derecede güçlü bir şekilde olmasa da, 2s2 elektronlarını vermeye ve metal gibi davranmayısısa hazır. Ancak, daha sonra gelen borondan başlayarak 2p yörüngeleri doldukça, elektron verme eğilimi giderek zayıflıyor. Oksijene gelindiğinde, bu eğilim tam tersine; elektron alma eğilimine, yani 'elektronegatif' özelliğe dönüşüyor. Çünkü 1s22s22p4 yörünge şemasına sahip olan oksijen artık, en dış kabuğunu 2 elektron alarak doldurmayısısı tercih ediyor. Flor ise bu işi tek bir elektronla yapabiliyor. Dolayısıyla, çok güçlü bir elektron alıcısı, güçlü bir 'elektronegatif' element. Dış kabuk nihayet dolduğunda karşımıza, kimyasal tepkimelere karşı ilgisiz bir asal gaz daha çıkıyor: Neon. Bu yüzden helyumun altına konmuş zaten tabloda... Bu arada n=2 kabuğu dolduruldukça, çekirdek yükündeki artışın baskınlığı nedeniyle, yarıçaplar giderek küçülüyor.
Halbuki bir sonraki sodyuma, Z=11 atomuna gelindiğinde; yeni bir (n=3) kabuğuna geçilmiş oluyor ve yarıçap birden büyüyor. En dış kabuğundaki tek elektronu kolayca vermeye hazır olan sodyum, bu yüksek elektropozitifliği sayesinde, tıpkı hidrojen ve lityum gibi, güçlü metal özellikler sergiliyor. Bu yüzden onların altında yer alıyor. Hatta, elektropozitifliği onlarınkinden daha bile yüksek. Çünkü en dış 3s elektronu, diğerlerinin 1s veya 2s elektronundan daha yüksek enerji düzeyine sahip ve bu nedenle, iyonlaşması daha kolay.
Sodyumdan sonraki magnezyum, gerçi sodyuma göre daha zayıf, ancak hala güçlü metal özelliği taşıyor. Fakat bu özellik, aluminyumla başlayarak, daha sonraki elementlerde giderek zayıflıyor. Kükürtten sonra ise sırada; elektron vermek bir yana, güçlü bir elektron alıcısı olan klor geliyor. Klor tıpkı, tabloda tam üstündeki flor gibi davranıyor. Ancak, elektron tutkusu onunki kadar güçlü değil. Çünkü, klorun en dış kabuğunu oluşturan 3p yörüngeleri, florun dış kabuğunu oluşturan 2p yörüngelerinden daha yüksek bir enerji düzeyine sahip. Dolayısıyla enerji ölçeğinde klor, 3p yörüngelerini doldurmak için aldığı elektronu, florun 2p yörüngelerine aldığı elektron kadar derinlere indiremiyor. Sonuç olarak da bu ek elektronu kendisine, florun yaptığı kadar güçlü bir şekilde bağlayamıyor. Yani, flora göre daha zayıf elektronegatif özellik taşıyor. Potasyuma geçildiğinde, tıpkı üstündeki sodyum gibi, elektropozitif bir elementle karşılaşılıyor. Hatta yeni bir enerji kabuğuna geçilmiş olduğundan; sodyuma göre yarıçap büyürken, elektron verme kolaylığı da artmış oluyor. Yani potasyum sodyuma göre, daha bile elektropozitif.
Elementler tablosu, benzer kimyasal özellikler sergileyen elemenlerin alt alta konmasıyla elde edilmiş. Bu yüzden; tablodaki dikey dizilere, yani sütunlara, kimyasal açıdan benzer elementler grubu anlamında, 'grup' deniyor. Yatay dizilere de 'periyot'...
Birinci periyotta, 1s yörüngesinden oluşan ilk kabuk dolduruluyor ve sadece iki element var. İkinci ve üçüncü periyotlarda, sırasıyla; 2s2 2p6 ve 3s2 3p6 yörüngeleri de dolduruluyor. Bu periyotlarda 8'er element var. Dördüncü ve beşinci periyotlarda, sırasıyla; 4s2 3d10 4p6 ve 5s2 4d10 5p6 yörüngelerinin doldurulması gerekiyor. Dolayısıyla bu satırlarda, 18'er element var. 3d ve 4d yörüngelerine karşılık gelenlere, metallerle metal olmayısısanlar arasında yer aldıklarından dolayı, 'geçiş elementleri' de deniyor.
Altıncı periyotta; 6s2 4f14 5d10 6p6 yörüngeleri doldurulduğundan, bu satırda 32 elementin bulunması gerekiyor. Ancak bu durumda tablo, enlemesine fazla uzayacağından; 4f yörüngelerinin doldurulmasına karşılık gelen 14 elementlik dizi, tabloda araya sokulmak yerine, aşağıya alınmış. Lantan'la başlayan bu alt diziye, 'lantanidler serisi' deniyor. Yedinci periyotta ise; 7s2 5f14 6d10 7p6 yörüngeleri doldurulduğundan, bu satırda da keza, 32 elementin bulunması gerekiyor. Ancak, yine tablo enini kısa tutabilmek amacıyla; 5f yörüngelerinin doldurulmasına karşılık gelen 14 elementlik dizi, benzer şekilde; araya sokulmak yerine, aşağıya alınıp, lantanidler serisinin altına yerleştirilmiş. Aktinyum'la başlayan bu alt diziye, 'aktinidler serisi' deniyor. Lantanid ve aktinid serileri birlikte, 'nadir toprak elementleri' olarak da biliniyor.
Kısacası; herhangi bir periyotta, yani satırda, soldan sağa doğru ilerledikçe; elementlerin elektropozitifliği veya metal özellikleri giderek zayıflarken, atom yarıçapları küçülüyor. Dikey dizilerden oluşan gruplara, soldan sağa doğru sırasıyla bakıldığında; birinci gruba 'alkali metaller' deniyor. Biraz zayıflayarak da olsa, benzeri metal özellikler taşıyan ikinci grup, 'alkali toprak elementleri' olarak biliniyor. 3'ten 8'e kadarki gruplar, metallerle metal olmayısısan elementler arasında, 'geçiş elementleri' olarak nitelendiriliyor. En sağdaki gruba 'asal gazlar,' bir öncekine de 'halojenler' deniyor. Herhangi bir grupta, aşağıya doğru inildikçe, atom yarıçapları büyüyor. Grubun sergilediği ortak kimyasal özelliğin gücü ise, yine aşağıya doğru inildikçe; soldaki gruplarda artarken, sağdaki gruplarda azalıyor.
Periyodik tablo, etrafımızı çevreleyen elementlerin kimyasal davranışlarına anlam verebilmek açısından, güçlü bir araç oluşturuyor: Her eve lazım. Ancak bu elementlerden bazılarının bazı çekirdekleri, hep öyle oldukları gibi kalmıyorlar. Bazen de durup dururken, 'zırt vırt' bozunuyorlar.

|
